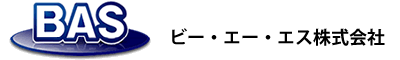トップページ > 電気化学計測 > これから電気化学を始める方のための基礎
電気化学における基礎と応用を解説した内容です。
その他はこちら
CVは電気化学計測のなかでも最も頻繁に使われている手法です。まず大まかに試料の中味について見当をつけようということでCVをとってみるというわけです。さらに進んで種々の有用な情報を取り出そうということになります。そのためにはCV法について理解している必要があります。CVのプロファイルをどのようにして読み取るか、測定パラメータをどのように設定したらよいのか、如何なる情報がえられるのか、などが初心者の疑問としてあるのではないでしょうか。
右図にCVから得られる情報を整理しました。あらわに見えるパラメータとして、Eo は 標準酸化還元電位、Epc、Epa(それぞれ還元および酸化ピーク電位、下付きのp、c、aはそれぞれピーク、カソーデック、アノーデックの意、ipc、ipa はそれぞれピーク電流値、ΔEpはピーク電位差)、ipc/ipaはピーク電流比、νは電位掃引速度で測定者が設定します。
あらわには見えないパラメータとしてはks(電子移動速度定数)、α(遷移係数)、溶液内反応の平衡定数(Ke)や反応速度定数(kf、kb)などがあります。

CVを測定する時、測定者が設定するパラメータには、開始電位、折り返し電位、終了電位(初期電位、高電位、低電位、初期極性などの呼び方もある)、電位掃引速度、繰り返し数、電流感度などがあります。
O + e ⇄ R の酸化還元反応について(Oは酸化体、Rは還元体)、平衡状態では
図1は電子移動を伴う酸化還元反応、O + e ⇌ R について可逆な系の典型的なCVです。1電子移動の可逆系では酸化と還元のピーク電位の幅は、ほぼ60 mVになります。可逆でないともっと広い電位幅になる。この辺のことは追々、述べてゆきます。酸化体 O が還元されて還元体 Rに変化するにつれ、電極表面において O と R の両方について濃度勾配が現われ、これらの勾配に沿って拡散が起こる(拡散とは濃い方から薄い方への移動ですから、電極表面で消費される酸化体O は沖合から電極方向へ、生成したR は電極表面から沖合に向かって移動することになります)。
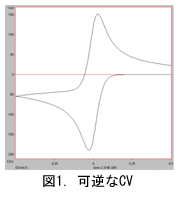
(1)で記述したように、電流値は電極表面における活物質の濃度勾配に比例します。O と R の濃度がCVの進行につれて変化する様子を電極表面からの距離に対してプロットしたのが図2、3です。図で薄緑の背景の左端が電極表面で右に向かって溶液沖合方向です。縦軸方向が濃度です。活物質のバルク濃度は1 mMです。電極から溶液の沖合いに向けて活物質濃度(黒線)と生成物濃度(赤線)がどのように変化するかを示しています。
電流は電極界面における濃度勾配と拡散係数に比例すること(i∝D(∂C/∂x) x=0)と、電極表面での活物質の濃度が電位掃引につれてどのように変化するかを意識することは、電極界面で起こっている反応とCVプロファイルを理解するのに役に立つ。図2のピークの立ち上がり付近では(CVの一番右の赤丸付近)、まだ電子移動速度が遅く、物質が十分、供給される状況です。いわゆる電子移動速度律速状態です。電位が深くなるにつれ電子移動速度が急増し、拡散による供給と電極表面での消失とが釣り合い状態になり電流のピーク(右から2番目の赤丸、表面濃度勾配は最大)が現れます。ピーク後は電子移動速度が十分大きく、供給が追い付かず、電流は減少してゆく(右から3番目の赤丸付近)。
この時点で電極表面における活物質Oの濃度はゼロで(濃度がゼロでも電流は流れる。電流は濃度勾配に比例するから)、表面濃度勾配は次第に減少して行く。それと共に濃度半量の位置は沖合に伸びて行く。赤線で示した生成物の濃度プロファイルは酸化体の濃度プロファイルをほぼ対称的に折り返したものになる(OとRの拡散係数が同じなら完全に上下対称)。
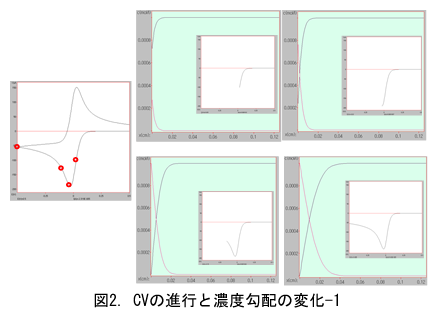
電位掃引を折り返すと(逆掃引、図3)、電流ゼロラインを超える前で、電極付近の生成物である還元体の酸化反応が始まる。それにつれ生成物濃度プロファイルにピークが見られるようになる。その裏返しで、活物質が再生され、表面濃度が元に戻りだす。OとRの濃度プロファイルに、それぞれ極小と極大が現れるわけです。極小と極大付近では移動の方向は電極表面方向と沖合方向が混在して複雑な動きになるがピーク位置は次第に沖合に伸びて行く。
pdf資料はこちらからダウンロードできます(約130 KB)
これは生成物の濃度分布を考えると理解できます(図1)。図1右は1回目の掃引の直後の状況です。還元生成物の濃度ピークが電極近傍にあります(活物質である酸化体の濃度ミニマムとほぼ同じ位置)。電極表面よりも高濃度ですから電極表面に向かって拡散します。これの酸化電流に依るものなのです(酸化体は逆に電極から沖合に遠ざかる動きをすることに注意)。
左右の図における青矢印↑の長さは同じです。2回目の掃引開始後のある時点での濃度プロファイルが図1の左図です。生成物のピーク濃度が明瞭に低下しています。気づき難いかもしれませんが、ピーク位置は左図の方が電極から遠ざかります。
電極からの距離スケールは左図の方が若干縮小して描かれている(時間経過のせいで)ことにご注意ください。左図のピーク濃度は明らかに減少していることがわかります。電極に向かう還元体の酸化反応によって消費されるからです。このような電極近傍における反応種の消長を頭に描けるとCVプロファイルの理解に役立つと思われます。
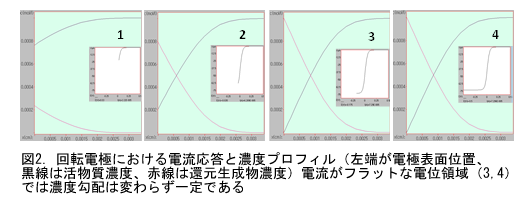
電極表面の濃度勾配と電流値の間の比例関係に触れたついでに、しつこいようですが少し付言します。回転電極や微小電極の使用においては、電位掃引に際して図2のようなフラットな電流応答が得られる(図2の4)。拡散に起因する減衰が伴わない、飽和した電流応答です。回転電極では強制的な対流によって、微小電極では球面拡散によって、いずれも効率的な輸送によって十分に活物質が供給される。それ故、この時の電極表面における濃度勾配は電位掃引中でも一定であることにご注意ください。
電極反応生成物が自身、変化してゆくか(分解など)、または共存物と溶液内化学反応する場合、界面濃度は影響を受けて波形が可逆系から大きくずれることになります。化学的に不可逆系と呼びます。ここまでに挙げたのはいずれも最も簡単な、化学的にも電気化学的にも可逆な場合の例でした。
pdf資料はこちらからダウンロードできます(約130 KB)
トップページ|電気化学 測定|電極&アクセサリ|光と電気化学|分光分析|お問い合わせ
電気化学における基礎と応用を解説した内容です。
その他はこちら
その8:CV(Cyclic Voltammetry)について(1)
右図にCVから得られる情報を整理しました。あらわに見えるパラメータとして、Eo は 標準酸化還元電位、Epc、Epa(それぞれ還元および酸化ピーク電位、下付きのp、c、aはそれぞれピーク、カソーデック、アノーデックの意、ipc、ipa はそれぞれピーク電流値、ΔEpはピーク電位差)、ipc/ipaはピーク電流比、νは電位掃引速度で測定者が設定します。
あらわには見えないパラメータとしてはks(電子移動速度定数)、α(遷移係数)、溶液内反応の平衡定数(Ke)や反応速度定数(kf、kb)などがあります。

CVを測定する時、測定者が設定するパラメータには、開始電位、折り返し電位、終了電位(初期電位、高電位、低電位、初期極性などの呼び方もある)、電位掃引速度、繰り返し数、電流感度などがあります。
O + e ⇄ R の酸化還元反応について(Oは酸化体、Rは還元体)、平衡状態では
E = Eo + (RT/nF) × ln(CO/CR) のネルンスト式が成り立ちます。
この式の意味するところは、
①電極界面における酸化還元系の濃度比によって電極電位が決まる
あるいは逆に、
②電極を分極すると、平衡状態では(可逆系ならば平衡状態は速やかに成り立つ)電極表面における濃度比が電極電位で決められる
ということを意味している。次にあげる電流と濃度勾配の式と共にCVプロファイルを考える際に重要な式なので覚えていて損はない。
CV法では時間とともに電位を掃引し、ある電位で逆戻りし、これを繰り返します。順方向の掃引で起こる電子移動による生成物を、逆掃引で調べられる。電極活性物質(活物質)があると電流が流れます。電流の流れやすさ(電子移動速度)は電位とともに変化します。酸化反応なら電位がプラス方向に増大するほど電子移動速度は増大します。次式のように電流は電極表面における活物質の濃度勾配に比例します。
i = D (∂C/∂x)x=0
C、Dはそれぞれ活物質の濃度と拡散係数、xは電極から溶液沖合いへの一次元的距離、下付きのx=0は電極表面を意味します。
電子移動を伴う酸化還元反応 O + e ⇄ R について、Oが還元されてRに変化するにつれて、電極表面において濃度勾配がOとRの両方について現われ、これらの勾配に沿って拡散が起こる(拡散は濃度の濃い方から薄い方へと起こります。今の場合Oは電極方向へ、Rは反対の方向へ拡散する)。CV測定において拡散を意識することは重要です。
pdf資料はこちらからダウンロードできます(約140 KB)
その8:CV(Cyclic Voltammetry)について(2)

(1)で記述したように、電流値は電極表面における活物質の濃度勾配に比例します。O と R の濃度がCVの進行につれて変化する様子を電極表面からの距離に対してプロットしたのが図2、3です。図で薄緑の背景の左端が電極表面で右に向かって溶液沖合方向です。縦軸方向が濃度です。活物質のバルク濃度は1 mMです。電極から溶液の沖合いに向けて活物質濃度(黒線)と生成物濃度(赤線)がどのように変化するかを示しています。

この時点で電極表面における活物質Oの濃度はゼロで(濃度がゼロでも電流は流れる。電流は濃度勾配に比例するから)、表面濃度勾配は次第に減少して行く。それと共に濃度半量の位置は沖合に伸びて行く。赤線で示した生成物の濃度プロファイルは酸化体の濃度プロファイルをほぼ対称的に折り返したものになる(OとRの拡散係数が同じなら完全に上下対称)。
電位掃引を折り返すと(逆掃引、図3)、電流ゼロラインを超える前で、電極付近の生成物である還元体の酸化反応が始まる。それにつれ生成物濃度プロファイルにピークが見られるようになる。その裏返しで、活物質が再生され、表面濃度が元に戻りだす。OとRの濃度プロファイルに、それぞれ極小と極大が現れるわけです。極小と極大付近では移動の方向は電極表面方向と沖合方向が混在して複雑な動きになるがピーク位置は次第に沖合に伸びて行く。

pdf資料はこちらからダウンロードできます(約130 KB)
その8:CV(Cyclic Voltammetry)について(3)
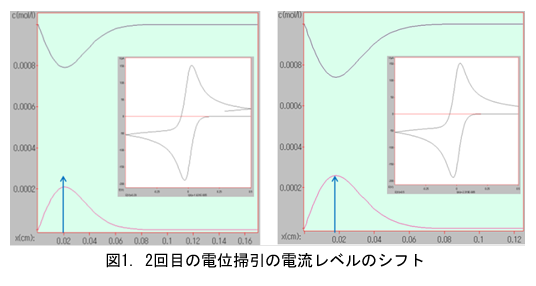
2サイクル目の電位掃引において電流レベルのシフトが起こるが、何故だろうと不思議に思われたことがありませんか。
左右の図における青矢印↑の長さは同じです。2回目の掃引開始後のある時点での濃度プロファイルが図1の左図です。生成物のピーク濃度が明瞭に低下しています。気づき難いかもしれませんが、ピーク位置は左図の方が電極から遠ざかります。

電極からの距離スケールは左図の方が若干縮小して描かれている(時間経過のせいで)ことにご注意ください。左図のピーク濃度は明らかに減少していることがわかります。電極に向かう還元体の酸化反応によって消費されるからです。このような電極近傍における反応種の消長を頭に描けるとCVプロファイルの理解に役立つと思われます。

電極反応生成物が自身、変化してゆくか(分解など)、または共存物と溶液内化学反応する場合、界面濃度は影響を受けて波形が可逆系から大きくずれることになります。化学的に不可逆系と呼びます。ここまでに挙げたのはいずれも最も簡単な、化学的にも電気化学的にも可逆な場合の例でした。
pdf資料はこちらからダウンロードできます(約130 KB)
トップページ|電気化学 測定|電極&アクセサリ|光と電気化学|分光分析|お問い合わせ