電気化学におけるレドックス電位についての基礎的な内容です。
その他はこちら
レドックス電位について(4):有機遷移金属錯体
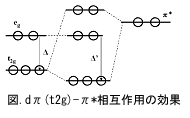
レドックス電位とHOMO-LUMOの対応については、有機遷移金属錯体を材料にするのは興味深い。金属周りの価電子数は18電子になることが多い(18電子則)。ここでは6配位、正八面体錯体を考える。配位子の作る結晶場の中で中心金属のd軌道は5重縮退が解けて、非結合性のt2g軌道(3重縮退)と反結合性のeg軌道(2重縮退)に分裂する(結晶場分裂Δ)。d軌道への電子の配置は、Δの大きさと電子対形成による不安定化エネルギー(P)との兼ね合いによって決まる。Pの方が大きければ、先にt2g軌道に3個まで、次いでeg軌道に2個入るという具合に、電子対形成を避けて平行スピン数が多い配置になる(高スピン型)。逆に、Δの方が大きいと、電子対形成による不利益の代償を払ってでも、より安定なt2g軌道に6個まで先に入る(低スピン型)。レドックス中心が金属の場合(HOMO、LUMOが金属からくる準位)、HOMO、LUMO準位がeg軌道であるかt2g軌道であるかによってレドックス電位は大きく異なってくる。t2g軌道であれば、より正電位に傾くことになる。結晶場理論では配位子の電荷による静電的相互作用から出発するので、σ結合的相互作用しか考慮しない。π
結合的相互作用を取り入れた配位子場理論や分子軌道理論がより現実に近い。金属の3d、4s、4p軌道(第一遷移金属の場合)と配位子の軌道(σとπ
軌道)の対称性が合ったもの同士が相互作用をする。一般に金属のd軌道は配位子のσ軌道より高く、配位子の空π
軌道(半結合性軌道)より低い。π
型のt2g軌道は配位子の空π
軌道と相互作用し、押し下げられる。この軌道とσ*軌道(eg由来)との間が結晶場分裂Δに相当する。結合に参加する金属の原子価軌道d5sp3軌道から18電子則が一般に成立することが納得できる(9個の各軌道に2電子入るので計18電子になる)。
 (t2g)-π
*相互作用の効果);
(t2g)-π
*相互作用の効果);
NH3 < NCR < PBu3 < PMe3 < P(OMe)3 < PPh3 < P(OPh)3 < PCl3 < PF3 < CNR < CO
t2g軌道がHOMO-LUMO準位ならば、安定化する方向(下向き)だから、レドックス電位は正方向にシフトすることになる。カルボニルやイソシアネートが配位した化合物のレドックス電位が正方向になるのはこのためである。一方、アミノ基はπ 受容性は低く、t2g軌道の低下はないので、アミノ化合物は負方向の電位を示しやすいことになる。
前回はカルボニルへの逆供与によって金属周りの電子密度が減ることにより酸化され難くなるからレドックス電位が+シフトすると述べたが配位子場理論による解釈では以上のようになる。