電気化学測定に使用する参照電極の種類とその用途、選択方法についての基礎的な内容です。
その他はこちら
これから電気化学を始める方のための参照電極の基礎-その2:Ag/AgCl電極
ポテンショスタットの機能の1つとして、参照電極につながる回路には電流は流れないようにする能力があるのはこのためである。
環境負荷が小さく、作り易くかつ使い易い参照電極は銀/塩化銀電極である。銀電極の表面では次の可逆な酸化還元反応が起こっている。
Ag + Cl‐ ⇄ AgCl + e
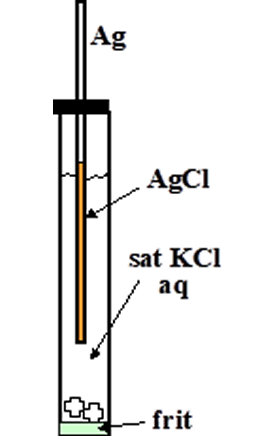
右向きが酸化反応、左向きが還元反応。これらが平衡している(同量で起こっている、どちらかが優先するのではない)。塩化物イオンは内部液に含まれる電解質(KCl や NaCl)から来る。Agは電極本体の銀線であり、AgClは銀線の表面に生成した固体である。銀/塩化銀電極を作るのは簡単で、表面を清浄にした銀線を、塩化物イオンを含む水溶液中(KCl溶液、HCl溶液など)で陽分極すればよい。表面にAgClの淡いピンク色の膜ができる(時間と共に黒ずんでくる)。この銀線をKCl水溶液に浸漬すれば銀/塩化銀電極ができる(上図)。上の反応式から電極電位は次のネルンスト式で与えられる。
溶解度積定数(KsAgCl = [Ag+][Cl-] = 1.6×10-10)を使って銀イオンの活量を置き換えると
ここで既知のE0Ag+=0.7991 VとKsAgCl = 1.6×10-10の値を入れると、よく知られた
が得られる。ここで aCl-は塩化物イオンの活量である。
この式は、電極電位は電解液中の塩化物イオン濃度が変化すれば変わることを示している(温度依存性もある)。
再現性を保つ必要条件は内部液中の塩化物イオン濃度を一定にしておくことである。飽和KCl溶液中では、標準水素電極に対して25°Cでは0.197 Vを示す。内部液濃度が増えれば電位がマイナスシフトする。
内部液が3M KClの場合では0.222 Vである。参照電極の内部電解質溶液は液絡を通じて外部の試料溶液と電気的に導通が図られている。液絡を通じて溶液の出入りがあるわけで、内部液の希釈や被検液の内部液による汚染が起こる。KCl の代わりに、 NaClを内部電解質として使う場合もある。
被検液に過塩素酸塩(ClO4-)が含まれると、カリウム塩(KClO4)の溶解度がナトリウム塩に比べて相当低く、液絡部に析出する可能性が大きいためである。KClを使う大きなメリットはカリウムイオンと塩化物イオンの易動度が、ほぼ同じなので液間電位の発生は大きくならないが、ナトリウムイオンと塩化物イオンのそれはかなり異なるため、NaCl が内部液だと液間電位の寄与が大きなくなる点で、痛し痒しというところである。功罪の軽重を考慮して選択するのが良いであろう。内部液の管理が不十分だと電位シフトがあることに注意しなければならない。
使用しない時は内部液と同じ濃度の液中に保存することが良い。液絡部の汚染や析出などによる導通不良によりインピーダンスが異常に増大すると、外部ノイズに対して脆くなりポテンショスタットが不安定になることがあるので注意が必要である。
pdf資料はこちらからダウンロードできます(約110KB)
![]()
トップページ|電気化学 測定|電極&アクセサリ|光と電気化学|分光分析|お問い合わせ