2-1 CVの基礎
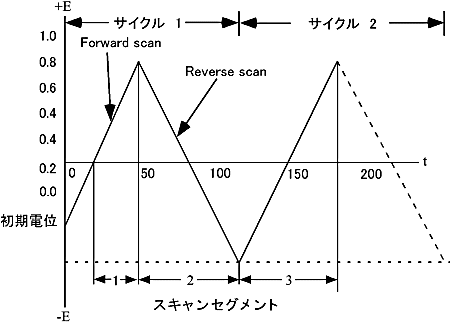
電気化学 測定テクニックの1つである、CV(サイクリックボルタンメトリー)は静止したサンプル溶液の中に電極を浸し、電位を繰り返しスキャンして流れる電流を測定するテクニックです。作用電極の電位は飽和キャロメル電極(SCE)または銀塩化銀電極(Ag/AgCl)のような参照電極に対してコントロールされています。コントロールポテンシャルは励起シグナルとしてみなされます。 CVの励起シグナルは三角波形の直線電位スキャンとなります(図2-1参照)。
三角波形ポテンシャルの励起シグナルはスイッチングポテンシャルと呼ばれる点でスイープの方向を変化させます。図2-1の励起シグナルでは参照電極に対して0.00 Vから-1.00 Vへ負方向にスキャンしそこで反転して正方向に元の0.00 Vにスキャンします。
勾配として表わされるスキャン速度は20 mV/secとなり、2回目のスキャンは点線で表わされています。ALS電気化学アナライザーのような測定器では上記パラメーターをキーボードから入力します。
サイクリックボルタモグラムは電流-電圧曲線として表わされます。電流はポテンシャル励起シグナルの応答シグナルとみなされます。電流-電圧軸は図2-2に示されます。ポテンシャルは時間に比例しますので、横軸は時間軸とみなすことができます。このことはCVテクニックの基礎を理解するのに役に立ちます。電極の酸化強度、還元強度は印加電圧によってコントロールされます。
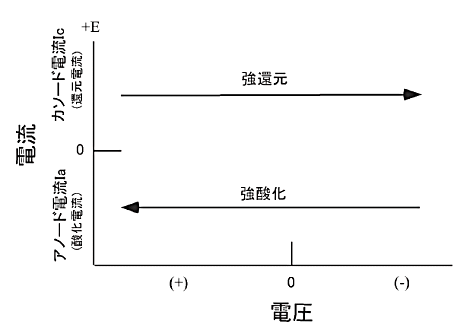
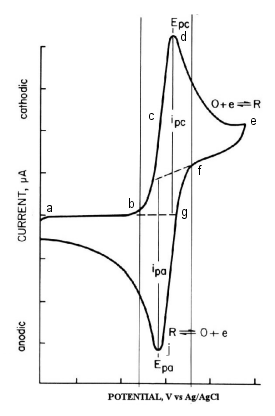
負方向のポテンシャルスキャンは電極を強い還元剤にします。一方、正方向のポテンシャルスキャンは電極を強い酸化剤にします。図2-3に典型的なサイクリックボルタモグラムを示します。作用電極として酸化スズフィルム、サンプルとして0.5 mM Methyl viologen di-cation(MV-2+)、支持電解質として0.1 M pH7.0リン酸バッファーを使用しました。
用いられた励起シグナルは図2-1に示したものですが、スイッチングポテンシャルは-0.92 Vです。初期電位は0.00 Vに設定します。
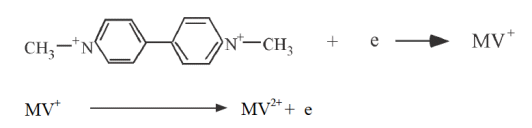
この電位では MV2+の電気分解は起こりません。MVを還元するためにポテンシャルを十分にマイナスにすると、次式の電極過程で還元電流が流れます。還元電流はb-dに進むとともに増加し、d で電極表面のMV2+濃度はゼロになります(ピークd)。
MV+への還元によりMV2+が電極表面で不足するので還元電流はt−1/2の依存性で減衰します。-0.92Vでスキャン方向を逆転しプラス方向にスキャンします。電極近傍に生成していたMV+が今度は酸化されて(次式)、酸化電流が流れます。酸化電流はgからj に進むにつれて増加し、j で電極表面のMV+濃度はゼロになります(ピークj)。
ポテンシャルがゼロになると1回目のスキャンが終了します。本ボルタモグラムから酸化ピーク電流(ipa)、還元ピーク電流(ipc)、酸化ピーク電位(Epa)、還元ピーク電位(Epc)が得られます。ALSモデル600シリーズを利用しますと電気化学 的に重要な記パラメーターはモニター上に表示されます。
アナログの計測装置の場合は、図2-3に示すボルタモグラムから算出します。標準酸化還元電位はE0=(Epa+ Epc)/2です。ピークポテンシャルの差は(△Ep=Epa-Epc=58/n) mV(n:1モル分子当たりの電子移動数)となります。
(スキャン速度20 mV/sec、電極表面積0.6 cm)
可逆過程のサイクリックボルタンメトリーではピーク電流はRandles-Sevcik式で表わされます。
ip=ピーク電流、n=equiv/モル、A=電極面積cm2、D=拡散係数 cm2/秒、
C=濃度mol/cm3、v=スキャン速度 V/s
本式に従い、ipは濃度Cに比例し、スキャン速度v1/2に比例します。CV曲線に影響を与える多数のパラメーターがあります。遅い電子移動反応では△Epを増加させます。
電子移動反応速度定数は△Epとスキャン速度を調べることにより算出することができます。ここで作用電極と参照電極の間の未補償抵抗は△Epを増加させますので注意が必要です。未補償抵抗の影響はiR補償を行なうことにより低減できます。